
2020 官网升级中!现在您访问官网的浏览器设备分辨率宽度低于1280px请使用高分辨率宽度访问。
近年来,基因治疗领域取得了显著的突破,腺相关病毒(AAV)成为了备受瞩目的基因治疗载体。AAV载体具有不整合宿主基因组、靶向组织特异性等核心优势成为常见及有效的基因治疗递送载体之一。国外AAV基因疗法已取得了不错的商业化进展,已有几款AAV基因疗法药物获批上市。随着AAV研究从实验室规模转向临床生产,需要面临上游生产和下游纯化过程的诸多重要挑战,以确保AAV产品的充足供应。
AAV病毒载体的生产流程主要包含三个部分,分别为上游环节、下游环节和制剂及灌装环节。上游环节是指AAV载体的生产阶段。下游环节是指通过分离、纯化手段,达到去除杂质、得到预期纯度AAV载体的阶段。制剂及灌装环节指在保证产品性状稳定的前提下,确定合适的制剂组成与剂量,并完成灌装。
上游生产得到的AAV颗粒都需要进一步纯化,因此下游处理步骤占病毒生产总成本的很大一部分,且难度很大,特别是纯化过程,因此有效地制备高纯度病毒的方法至关重要。

图源摄图网(已获授权)
近些年,研发人员开发了多种AAV下游纯化方法。以下为典型的纯化流程,包括:细胞裂解——核酸去除——层析纯化前,去除细胞碎片-亲和层析去除宿主细胞蛋白(HCPs)和任何血清蛋白杂质——超速离心程序或离子交换层析,分离包含完整基因的传染性病毒与空的非传染性病毒——纯化。
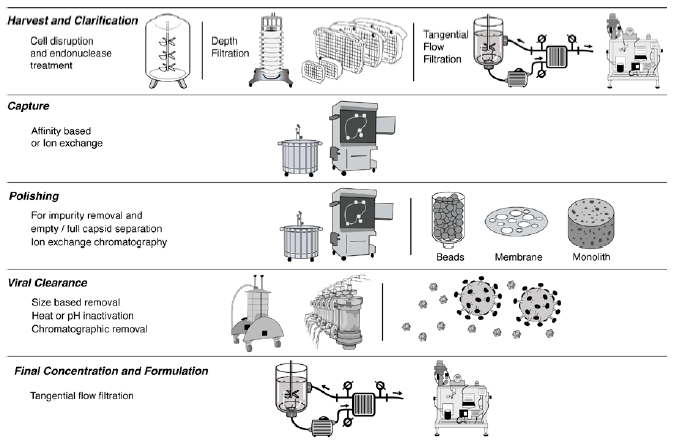
▲ 典型AAV下游工艺示意图(来源:公开网站)
在裂解细胞后,细胞内的宿主DNA、RNA及其它游离DNA等核酸被释放了出来,这些核酸污染物会降低AAV制备物的纯度,影响疗效和安全性。为了解决这一问题,研究人员采用了多种方法,其中之一是应用广谱核酸酶。
广谱核酸酶,又称全能核酸酶,在功能上,它能够剪切各种形式DNA和RNA,无论是单链、双链、线状、环状或超螺旋形式的DNA和RNA,切断磷酸二酯键从而产生5’-磷酸核苷酸或5’-磷酸寡核苷酸。
根据WHO和各国药物注册监管机构要求,生物制剂中残留的宿主DNA的剂量通常不得超过100 pg/剂量,部分特殊情况下不得高于10 ng/剂量。在AAV病毒生产中,由于大规模细胞扩增,细胞裂解液中往往含有大量的宿主细胞DNA和RNA。因此,常使用广谱核酸酶应用于生产工艺流程中来有效降低宿主细胞DNA(HCDNA)残留超标的风险。
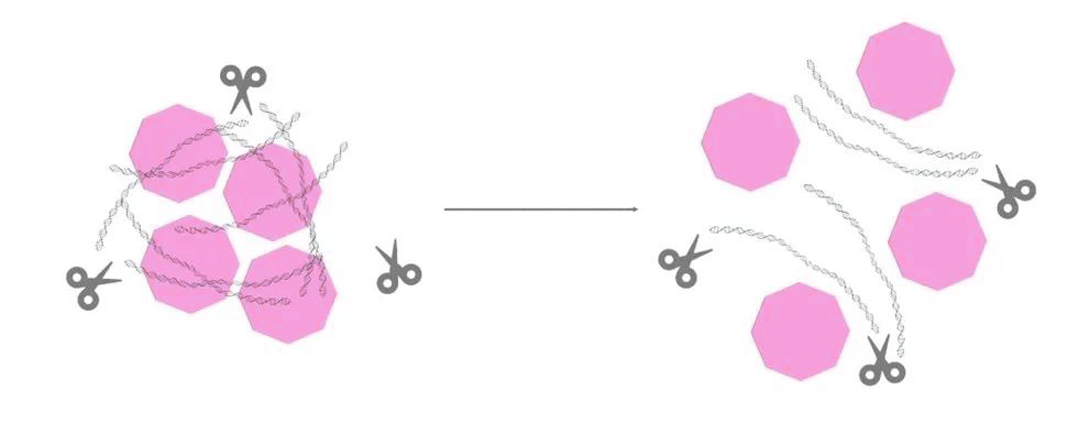
在AAV病毒的生产和纯化过程中,正确使用广谱核酸酶至关重要。这里包括:反应温度、体系、时间、酶的浓度、停止反应条件等多种因素,关于如何使用可以参考之前发布的干货分享| 广谱核酸酶的使用,你学会了吗?一文中就有详细描述。
↑ 点击图片了解文章详情
↑ 点击图片了解产品详情
高度稳定性
比活性大于 1000 KU/mg 蛋白
无动物源性成分
避免原核细胞的内毒素污染
不含蛋白酶残留
供应稳定,到货快
【产品数据】-纯度检测
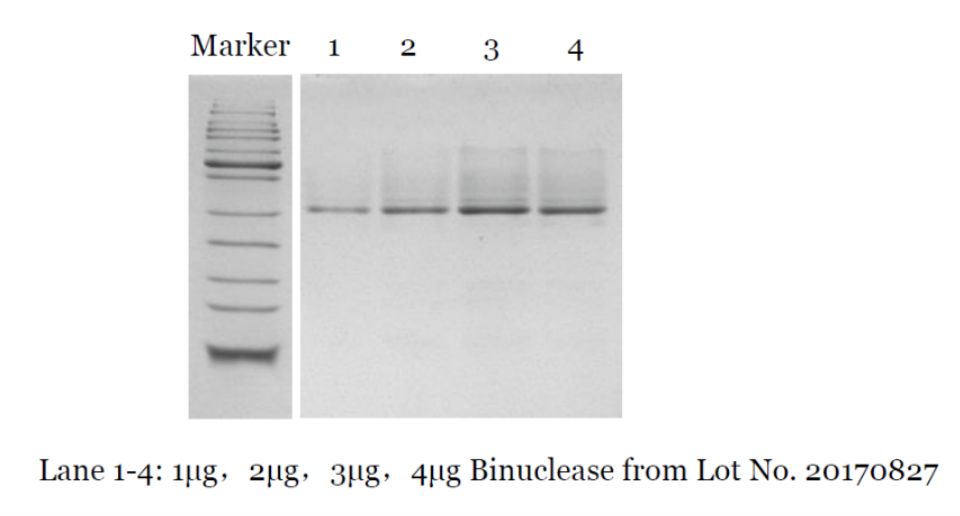
√ 纯度≥90%(Native-PAGE)
【产品数据】-蛋白酶污染测定
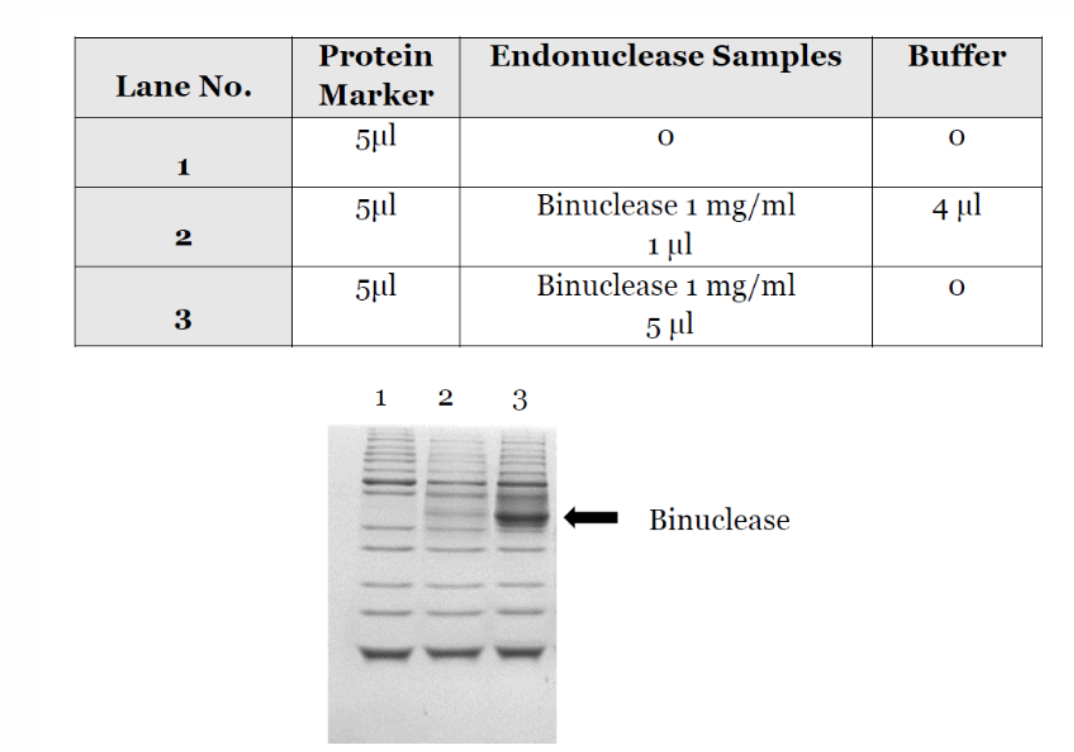
√ 未检测到蛋白酶活性
结语:广谱核酸酶在AAV病毒生产和纯化中是解决DNA和RNA污染物问题的重要工具。通过正确使用广谱核酸酶,研究人员可以提高AAV制备物的纯度和质量,从而为基因治疗和生物医学研究提供高质量的AAV样品。随着这一领域的不断发展,我们有望看到更多创新的方法和技术优化来降低直接成本。