
2020 官网升级中!现在您访问官网的浏览器设备分辨率宽度低于1280px请使用高分辨率宽度访问。
想象一下,口腔溃疡像不速之客般反复纠缠,牙周炎让牙齿“摇摇欲坠”,传统材料总在湿漉漉的战场上败下阵来!于是研究人员逐渐将重心转移到了贻贝粘蛋白(MAP)的身上,它藏着DOPA和儿茶酚这些“多才多艺”的基团,不仅像超级胶水般在潮湿中牢牢粘住一切,还能抗炎杀菌、驱散氧化“坏家伙”,MAP涂层稳固牙植骨整合;PVA-DOPA薄膜借儿茶酚“牵手”纳米颗粒,直捣溃疡。本文精选多篇文献,不妨随小编一起来解锁MAP在口腔健康中的活力革命吧~
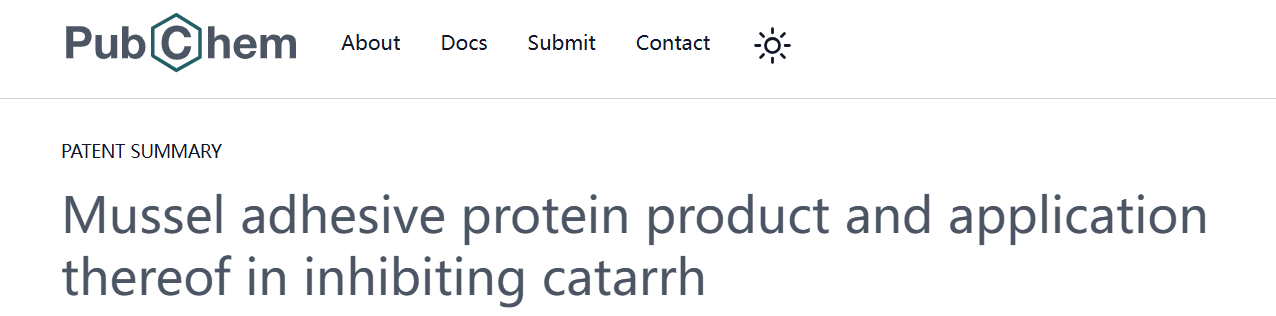
口腔粘膜炎是发生在口腔或软组织的疾病,临床表现为口腔粘膜病指口腔内粘膜的损坏,具体症状为:口舌溃烂,舌体干裂,声音嘶哑,口干口苦,继而引发口腔扁平苔藓,口腔炎,复发性口疮,唇炎等口腔疾病,导致饮食困难。口腔粘膜炎可导致体内多种并发症,直接影响病患的身体健康及生活工作。本篇提供了一种用于抑制粘膜炎症的含贻贝粘蛋白的凝胶剂与泡沫剂,其中对于复方阿弗他溃疡病患(靶溃疡直径小于1cm),使用浓度为10.0mg/ml的贻贝粘蛋白溶液1ml,加入9ml的0.1%柠檬酸溶液,配制成1.0mg/ml的贻贝粘蛋白水溶液。
分对照组与试验组,对照组采用0.1%柠檬酸溶液,试验组使用贻贝粘蛋白溶液,每日三次,饭后喷涂,每次喷涂2-3次,连续5天后,试验组6例病患均痊愈,而对照组仅1例病患痊愈[1]。
种植牙已成为义齿修复的关键手段,并日益获得患者的广泛接受与认可。这一趋势也推动了二氧化钛等常用生物医用材料用量的显著增长。与此同时,当前关于植入材料的研究已不再局限于单一的表面处理方式。研究人员倾向于采用至少两种不同的植入材料处理方法来提高其生物相容性。贻贝粘蛋白(MAP)是具有黏附特性的蛋白质,经过翻译后修饰,含有多巴(DOPA),并且具有较高的等电点。受贻贝粘蛋白的特性启发,人们开发出了在液体环境中仍能保持黏附性的生物材料。在本篇研究中,实验人员用MAP对纳米网络结构钛(TNS)材料表面进行包覆,并通过体外和体内实验来确定所得复合材料(TNS-MAP)的生物学性能是否优于单独的TNS材料。
图A和图B
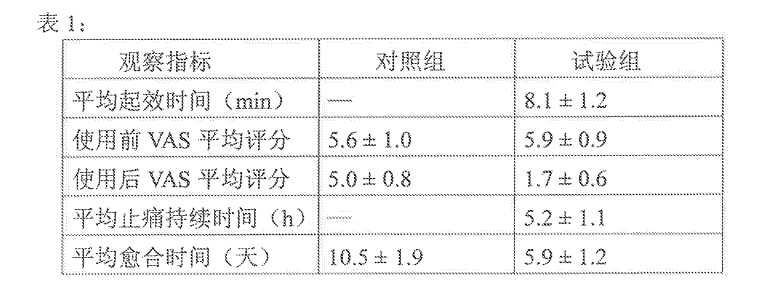
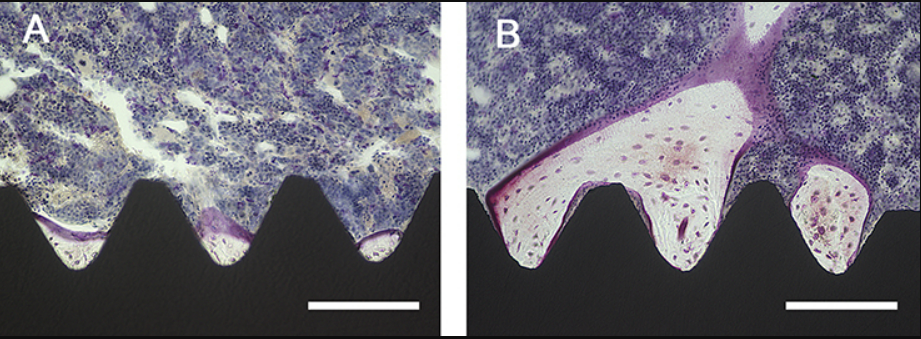
图A和B展示了种植体及其周围骨组织的纵向图像。TNS-MAP种植体表面附着的新骨量大于TNS种植体。术后8周,TNS-MAP 种植体的骨吸收率 (BA) 和骨结合率 (BIC) 均显著高于 TNS 种植体(图C;P < 0.05)[2]。

图C
研究探讨了TNS和TNS-MAP的表面特性,并分析了细胞黏附、细胞增殖和成骨分化相关基因的表达。同时,科研人员利用TNS和TNS-MAP进行了体内实验。结果表明,MAP成功包覆于TNS表面,且TNS-MAP在早期细胞黏附、增殖和成骨分化方面均优于TNS。体内实验结果与体外实验结果相符。

近期研究证实,利用不同的仿生生物材料进行牙周韧带工程化构建、再生或替代,是干预并缓解牙周炎和种植体周围炎症的一种潜在预防方案。本文概述了不同仿生材料在牙科领域的应用,并探讨了治疗牙周炎与种植体周围炎症的仿生解决方案及其关键技术。重点介绍了贻贝粘蛋白(MAPs)的新应用及其与牙周膜(PDL)的工程化、再生和替代相关的关键化学特性。
仿生生物材料,顾名思义,是指在解剖学和生理学上模仿人体组织的生物材料,旨在产生与天然组织相似的效果。牙周组织是由牙龈、牙周膜、牙骨质和牙槽骨等组织构成的,它们支撑并固定牙齿。牙周炎是一种慢性炎症性疾病,会破坏牙周组织,导致牙齿脱落,并给患者带来严重的口腔功能和美观问题。由于传统方法如引导组织再生术 (GTR)),其标准材料是聚四氟乙烯 (PTFE) ,而二次手术的需求可能会干扰愈合过程并增加感染风险,且不足以达到预期的治疗效果。因此,实现牙周炎患者牙周组织在结构与功能上的再生,有赖于开发新的替代性再生技术。
而贻贝粘蛋白(MAPs)作为一种仿生生物材料,富含高含量的儿茶酚基团,它们具有很高的反应活性,可以与多种表面形成牢固的化学键;已知赋予MAPs独特黏附性能的特定儿茶酚基团是3,4-二羟基-L-苯丙氨酸(DOPA),大量的研究表明,贻贝粘蛋白的粘附强度与多巴浓度成正比。
MAPs作为种植体表面涂层,已被理论化并评估其促进骨整合的潜力。研究发现,MAPs涂层种植体可显著提高骨髓干细胞的分化程度(通过碱性磷酸酶活性和茜素红染色评估)。此外,在模拟体液中进行的仿生矿化实验表明,MAPs表面涂层可显著增加矿物晶体的数量[3]。目前,MAPs在再生和替代关键牙周组织结构方面的应用已得到广泛研究,基于这些研究中报道的技术,MAPs的应用也可扩展到种植体表面处理和骨移植涂层领域,具有巨大的潜力。

据估计,约80%的患者患有严重的针头恐惧症。口腔给药具有无创、无痛、便捷的优点,与口服和注射给药相比具有显著优势。经口腔黏膜给药避免了胃肠道酶降解和肝脏首过代谢问题,这有助于提升患者治疗体验并改善临床预后。然而,唾液冲洗、吞咽和口腔运动都会影响制剂在口腔内的停留时间。因此,有效的口腔给药同时面临双重挑战:既要在湿润环境中保持牢固黏附,又要让药物有效扩散并依次穿透黏液层与上皮层以实现吸收。
贻贝粘蛋白富含高含量DOPA,而DOPA的儿茶酚基团在交联过程中具有极佳的可操作性,因为它既可以形成共价键,也可以形成非共价键。受贻贝粘蛋白中这种官能团的启发,研究人员对多种粘膜粘附聚合物进行改性而开发了儿茶酚功能化的粘合剂。本篇研究提出了一种由粘膜粘附聚合物聚乙烯醇(PVA)和贻贝粘附蛋白DOPA复合制成的可调控薄膜(PVA-DOPA薄膜)。
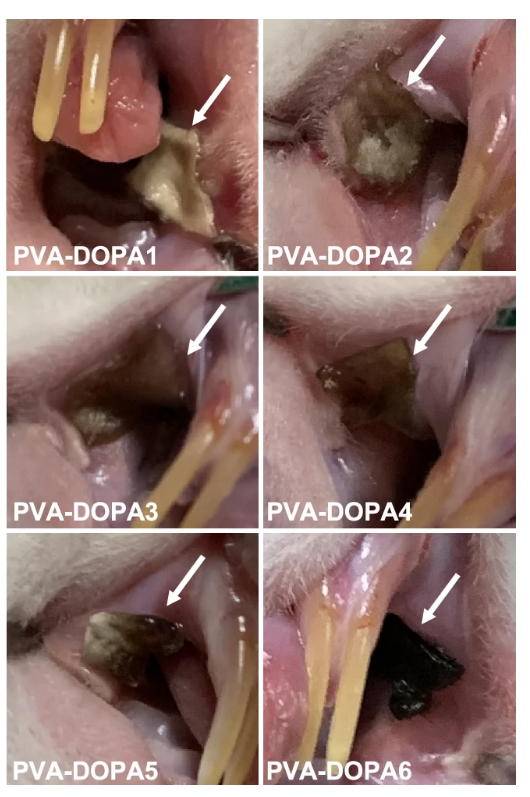
图:不同DOPA含量的PVA-DOPA薄膜在4h后的体内黏膜黏附性。白色箭头:PVA-DOPA薄膜。
通过动物实验证明,该薄膜能够与湿润的口腔组织实现牢固粘附并具有良好的机械匹配性。且该薄膜的粘膜粘附强度和侵蚀速率与DOPA的含量成正比,并可调。同时研究人员将市售康华地塞米松溃疡膜与不同载有地塞米松的PVA-DOPA@NPs薄膜治疗口腔溃疡的疗效进行对比发现,与市售康华地塞米松膜®相比,三种PVA@NPs/PVA-DOPA@NPs薄膜均显示出更好的治疗效果,再次证明了PVA-DOPA在延长薄膜停留时间方面的作用[4]。
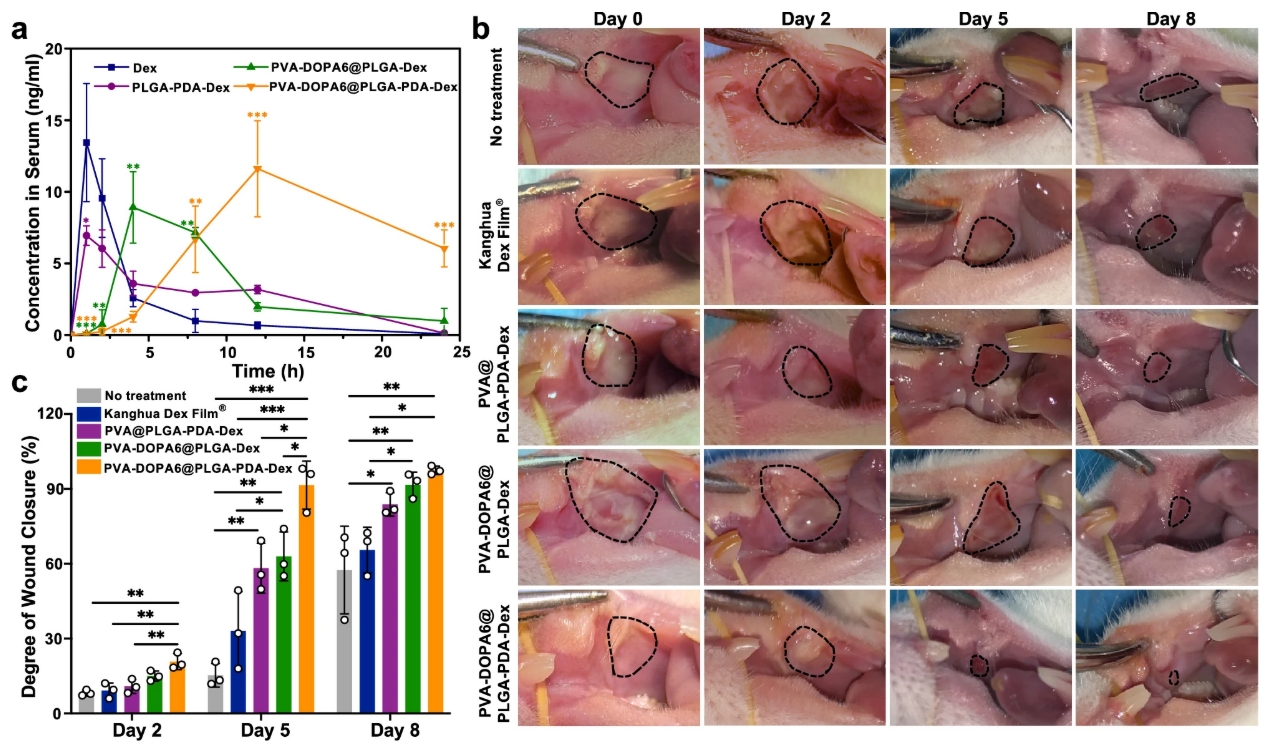
图 :PVA-DOPA@NPs薄膜在口腔溃疡中的体内药代动力学研究和治疗效果

结语:贻贝粘蛋白携DOPA与儿茶酚的多重功效,正逐步革新口腔医学领域,从牙周修复到粘膜保护,帮助缓解溃疡反复发作,并提升植入材料的稳定性和整合效果。尽管当前研究仍面临生物相容性和临床转化等挑战,这些前沿探索为未来口腔护理开辟了新路径,让更可靠的解决方案触手可及。
相关文献
[1] Gao M , Samuelsson B I .Mussel adhesive protein product and application thereof in inhibiting catarrh:AU20160309397[P].AU2016309397B2[2025-12-11].
[2] Yin D , Komasa S , Yoshimine S ,et al. Effect of mussel adhesive protein coating on osteogenesis in vitro and osteointegration in vivo to alkali-treated titanium with nanonetwork structures[J].International Journal of Nanomedicine, 2019, 14.DOI:10.2147/IJN.S206313.
[3] Kwan J C, Dondani J, Iyer J, et al. Biomimicry and 3D-printing of mussel adhesive proteins for regeneration of the periodontium: a review[J]. Biomimetics, 2023, 8(1): 78. doi:10.3390/biomimetics8010078.
[4] Hu S , Pei X , Duan L ,et al.Author Correction: A mussel-inspired film for adhesion to wet buccal tissue and efficient buccal drug delivery[J].Nature Communications, 2024, 15(1).DOI:10.1038/s41467-024-48275-4.